অবস্থান্তর মৌল কাকে বলে? অবস্থান্তর মৌলের বৈশিষ্ট্য

আসসালামু আলাইকুম শিক্ষার্থীরা! কেমন আছেন সবাই? আজকে আপনাদের সাথে অবস্থান্তর মৌল বা অবস্থান্তর ধাতু নিয়ে আলোচনা করবো। রসায়নের জন্য গুরুত্বপূর্ণ একটি টপিক অবস্থান্তর মৌল। আজকের এই পোষ্টে অবস্থান্তর মৌল কাকে বলে, অবস্থান্তর মৌল কোনগুলি, এদের ধর্ম ও বিভিন্ন রাসায়নিক বৈশিষ্ট্য তুলে ধরবো। এছাড়া গুরুত্বপুর্ণ কিছু প্রশ্নের উত্তর দেওয়ার চেষ্টা করবো। ইন-শা-আল্লাহ পুরো পোষ্টে আপনাদের জন্য অবস্থান্তর মৌল এর গুরুত্বপূর্ণ সব বিষয় তুলে ধরবো।
অবস্থান্তর মৌল কি?
অবস্থান্তর মৌল কাকে বলে?- যেসব মৌল সুস্থিত আয়নিত অবস্থায় d অরবিটাল আংশিক পূর্ণ থাকে তাদের অবস্থান্তর মৌল বলে। অবস্থান্তর মৌল সমূহ ধাতু হওয়ায় এগুলো অবস্থান্তর ধাতু (Transition Metal) নামেও পরিচিত। পর্যায় সারণির IB - VIIIB গ্রুপে (অর্থাৎ গ্রুপ ৩ থেকে ১২ বা ৩য় কলাম থেকে ১২তম কলামে) এসকল অবস্থান্তর ধাতুর অবস্থান।IUPAC (International Union of Pure Applied Chemistry) সংজ্ঞা অনুসারে অবস্থান্তর ধাতু হল, কোন উপাদান (element বা মৌল) যার অণুতে অসম্পূর্ণ d উপস্তর থাকে, অথবা যার কোন সুস্থিত ক্যাটায়নে অসম্পূর্ণ d-উপস্তর থাকে। - উইকিপিডিয়া
তাহলে শর্ত দাড়াচ্ছে কোন মৌল অবস্থান্তর ধাতু বা অবস্থান্তর মৌল হবে যদি মৌলটি-
- d-ব্লক বা গ্রুপ ৩ থেকে গ্রুপ ১২ তে অবস্থান করে ও
- সুস্থিত আয়নিত বা ক্যাটায়ন অবস্থায় d-উপশক্তিস্তর আংশিক পূর্ণ থাকবে।
কেন d ব্লক মৌলকে অবস্থান্তর ধাতু বলে?
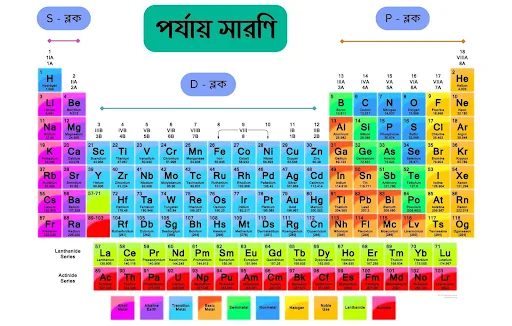
আপনারা উপরের পর্যায় সারণিতে লক্ষ্য করলে দেখতে পাবেন d ব্লক মৌল সমূহের বাম পাশে রয়েছে ধাতু, অন্য দিকে ডান পাশে অধাতু রয়েছে। আমরা জানি পর্যায় সারণিতে মৌলসমূহকে এমনভাবে সাজানো হয়েছে যেন বাম দিক থেকে ডান দিকে যেতে থাকলে মৌল সমূহের ধর্ম/বৈশিষ্ট্য/আচরণ পর্যায়ক্রমে পরিবর্তিত হয়। ফলে সেই হিসেবে সবচেয়ে বামের মৌলগুলো ধাতব ধর্ম প্রদর্শণ করলে সবচেয়ের ডানের মৌলগুলো অধাতুর ধর্ম প্রদর্শন করবে। আর ধাতু (s ব্লক) ও অধাতু (p ব্লক) এর মাঝে অবস্থান্তর ধাতু (d ব্লক) সমূহের অবস্থান হওয়ায় এসব মৌলসমূহে ধাতু ও অধাতুর মধ্যবর্তী ধর্ম দেখা যায়।
চিন্তা করে দেখুন! যদি একদম বাম পাশের ধাতব ধর্ম থেকে পর্যায়সারণীর মৌলসমূহ ধীরে ধীরে ডান পাশের অধাতব ধর্মে রূপান্তরিত হয় তাহলে নিশ্চয় এদের মাঝে থাকা আগেরদিকে (বামদিকের) মৌলসমূহ ধীরে ধীরে ধাতব ধর্ম হারাতে থাকবে আর শেষের দিকের মৌলগুলো তুলনামূলক ভাবে বেশি অধাতব ধর্ম প্রদর্শন করতে চাইবে, রাইট? অর্থাৎ এই d -ব্লকে অবস্থানরত মৌলের মধ্যদিয়ে ধর্ম/বৈশিষ্টের স্থানান্তর বা ট্রানজিশন (Transition) ঘটে।
উদাহরণ স্বরূপ - ধাতুসমূহ (s ব্লক বা d ব্লকের আগের মৌলসমূহ) উচ্চ সক্রিয়, তড়িৎ ধনাত্নক এবং আয়নিক যৌগ গঠন করে। অন্যদিকে অধাতু সমূহ (p ব্লক বা d ব্লকের পরের মৌলসমূহ) দূর্বল সক্রিয় হতে একদম নিস্ক্রিয়, তড়িৎ ঋণাত্নক, সমযোজী যৌগ গঠন ইত্যাদি অধাতব ধর্ম প্রদর্শন করে। আর d ব্লক মৌল, s ও p ব্লক মৌলের মধ্যবর্তী ধর্ম প্রদর্শন করে বলেই এদের অবস্থান্তর মৌল বলে।
* সকল d ব্লক মৌল অবস্থান্তর ধাতু নয়
d - ব্লক মৌলকে অবস্থান্তর গ্রুপ বলা হলেও শর্তানুসারে d -ব্লকে কিছু মৌল আছে যেগুলো অবস্থান্তর ধাতু না। যেমন- Zn, Cd, Hg। এদের সুস্থিত ক্যাটায়ন অবস্থায় d - উপশক্তিস্তর পূর্ন থাকে অথবা ইলেকট্রন শূণ্য থাকে। ফলে d ব্লক মৌল হয়েও এরা অবস্থান্তর ধাতু নয়। [* গুরুত্বপূর্ণ টপিক]যেমন, d ব্লকের প্রথম মৌল স্ক্যান্ডিয়াম (Sc, 21) এর ইলেকট্রন বিন্যাস ও সুস্থিত ক্যাটায়নের ইলেকট্রন বিন্যাস
21Sc: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹
21Sc3+: 1s2 2s2 2p6 3s2 3p6.
এখানে লক্ষ্য করলে দেখবেন যে স্ক্যান্ডিয়াম (Sc, 21) এ d উপশক্তিস্তরে 1টি ইলেকট্রন থাকলেও, এর সুস্থিত ক্যাটায়নের ইলেক্ট্রন বিন্যাসে d শেল অনুপস্থিত। তাই স্ক্যান্ডিয়াম (Sc, 21) অবস্থান্তর মৌল বা অবস্থান্তর ধাতু না।
আবার জিংক (Zn) , ক্যাডমিয়াম (Cd), মার্কারি (Hg) ইত্যাদি মৌল সমূহের সুস্থিত আয়নিত অবস্থার ইলেকট্রন বিন্যাস করলে দেখবেন যে এগুলো অবস্থান্তর মৌল হওয়ার বৈশিষ্ট পূর্ণ করে না। তাই সাধারণভাবে অবস্থান্তর ধাতুসমূহ d-ব্লক মৌল/ধাতু নামে পরিচিত হলেও মূলত সকল d-ব্লক মৌল অবস্থান্তর ধাতু না।
নিজে করুনঃ
জিংক, ক্যাডমিয়াম, মার্কারি, টাইটানিয়াম অবস্থান্তর মৌল নয় কেন ব্যাখা কর।
কপার (Cu) ও জিংক (Zn) এর ইলেকট্রন বিন্যাসে এদের সর্বশেষ d উপশক্তিস্তরে ১০ টি করে ইলেকট্রন থাকলেও, কপার অবস্থান্তর মৌল কিন্তু জিংক অবস্থান্তর মৌল নয় কেন ব্যাখাটি কর।
(সাহায্য লাগলে কমেন্টে জানান)
অবস্থান্তর মৌলসমূহের বৈশিষ্ট্য
সাধারণ বৈশিষ্টঃ
- বহিস্থস্তরে সল্প সংখ্যক ইলেকট্রন থাকায় সব অবস্থান্তর মৌল ধাতব প্রকৃতির। তাই এরা তাপ ও বিদ্যুৎ পরিবাহী।
- বেশির ভাগ অবস্থান্তর মৌলের যোজনী স্তরে অযুগ্ম ইলেকট্রন থাকায় এর প্যারাচৌম্বকীয়, অর্থাৎ চুম্বক আকর্ষণ করে।
- সকল অবস্থান্তর মৌলই আদর্শ লুইস অম্ল (Lewis Acids)। কারণ এদের d উপশক্তিস্তর ফাঁকা থাকায় জোড়ায় জোড়ায় ইলেক্ট্রন গ্রহন করতে পারে।
- অবস্থান্তর মৌল সমূহ পরিবর্তনশীল যোজত্যা প্রদর্শন করে। ***
- অবস্থান্তর মৌল সমূহ জটিল যৌগ গঠন করতে পারে। ***
- অবস্থান্তর মৌল সমূহ রঙিন যৌগ গঠন করে। ***
- এছাড়াও অধিকাংশ অবস্থান্তর মৌল ও এদের যৌগ সমূহ ভালো প্রভাবক হিসেবে কাজ করে।
অবস্থান্তর মৌল সমূহ পরিবর্তনশীল যোজত্যা প্রদর্শন করে
অবস্থান্তর ধাতুসমূহের পরমাণুর বহিস্তরে অপূর্ণ d-অরবিটালে অযুগল ইলেকট্রন থাকে । কোন শক্তিস্তরের প্রতিটি d অরবিটালের শক্তি সমান। তাই বিভিন্ন অবস্থায় বিভিন্ন সংখ্যক অযুগল d-ইলেকট্রন ব্যবহার করে একই অবস্থান্তর ধাতুর ভিন্ন ভিন্ন জারণ অবস্থা সৃষ্টি হয়।আবার অবস্থান্তর ধাতু সমূহ উচ্চ তড়িৎঋণাত্মক মৌলের উপস্থিতিতে উত্তেজিত হয়ে বিভিন্ন অবস্থায় পরমাণুর ইলেকট্রন যুগল ভেঙে বহিঃস্থ ফাঁকা d-অরবিটালে উন্নীত হয়ে বিভিন্ন সংখ্যক অযুগ্ম ইলেকট্রন সৃষ্টি হয়। এর ফলেও সংযোগের সম্ভাব্যতা বৃদ্ধি পায়। অর্থাৎ জারণ মান পরিবর্তিত হয়।
এছাড়া 3d এবং 4s অর্বিটালের শক্তি প্রায় সমান হওয়ার জন্য এই অর্বিটাল গুলো সংকর বা হাইব্রিড অর্বিটাল তৈরি করে। বিভিন্ন অর্ধপূর্ণ সংকর অরবিটাল ব্যবহার করে বিভিন্ন জারণ অবস্থার যৌগ গঠিত হয়।
অবস্থান্তর মৌল সমূহ জটিল যৌগ গঠন করতে পারে।
অবস্থান্তর ধাতু সমূহের জটিল যৌগ গঠনের বেশ কয়েকটি কারণ রয়েছ, এগুলো হলো- অবস্থান ধাতুর আয়নসমূহের বহিঃস্তরে ফাঁকা বা অর্ধপূর্ণ d অরবিটাল থাকায় প্রতিটি লিগান্ড থেকে ১ জোড়া করে অব্যবহৃত ইলেকট্রন ফাকা অরবিটালে গৃহীত হয়। ফলে যোজ্যতা বন্ধন মতবাদ অনুসারে অবস্থান্তর ধাতুর আয়নের সঙ্গে একাধিক লিগান্ড সন্নিবেশ বন্ধন দ্বারা যুক্ত হয়ে জটিল যৌগ গঠন করে। এজন্য শুধুমাত্র অবস্থান্তর ধাতুসমূহই জটিল যৌগ গঠনে সক্ষম।
- অবস্থান্তর ধাতুরই পরমাণুর বহিঃস্থ সমশক্তির ডিজেনারেট d অরবিটালগুলো নিকটবর্তী s ও p অরবিটালের সঙ্গে মিলে সমশক্তির সংকর অরবিটাল গঠন করতে পারে
- অবস্থান্তর ধাতুসমূহের ক্যাটায়নের উচ্চ চার্জ ঘনত্বের কারণে এরা লিগাল্ডের মুক্ত ইলেকট্রন জোড়কে সহজে টেনে নিয়ে সন্নিবেশ বন্ধন গঠন করতে পারে।
- অবস্থান্তর ধাতুসমূহ পরিবর্তনশীল জারণ অবস্থা দেখাতে পারে বলে জারণ অবস্থার পরিবর্তনের জন্য লিগান্ড থেকে সহজে ইলেকট্রনযুগল গ্রহণ করে সন্নিবেশ বন্ধন দ্বারা যুক্ত হতে পারে।
অবস্থান্তর মৌল সমূহ রঙিন যৌগ গঠন করে
অবস্থান্তর ধাতু ও আয়নে অপূর্ণ d অরবিটাল বা সর্ববহিস্থ d উপশক্তিস্তরে অযুগ্ম ইলেকট্রন থাকার জন্য এরা রঙিন যৌগ গঠন করে।অবস্থান্তর ধাতুর পরমাণুর বহিঃস্তরের d অরবিটালসমূহের শক্তি সমান। একে ডিজেনারেট অবস্থা বলে। কিন্তু যৌগ গঠনের সময় অন্য পরমাণুর অরবিটালের সঙ্গে অবস্থান্তর ধাতব আয়নের d অরবিটালের অধিক্রমণ ঘটায় d অরবিটালসমূহের মধ্যে শক্তির কিছুটা পার্থক্য সৃষ্টি হয় (নন-ডিজেনারেট অবস্থা)। এই অবস্থায় d অীবিটালের নিম্ন শক্তিস্তর হতে উচ্চ শক্তিস্তরে ইলেকট্রনকে উন্নীত করতে সামান্য পরিমাণ শক্তির প্রয়োজন পরে।
এ অবস্থায় যৌগের দ্রবণে আলো পড়লে d অীবিটালের ইলেকট্রন দৃশ্যমান অঞ্চলের আলো (λ = 3800−7600Å) শোষণ করে কাছাকাছি উচ্চ শক্তির অপর d অরবিটালে স্থানান্তরিত হয়। এই শোষিত দৃশ্যমান আলো (তড়িৎ চৌম্বকীয় রশ্মি) নির্ভর করে নিম্ন শক্তিস্তর হতে উচ্চ শক্তিস্তরের শক্তির পার্থক্য তথা ΔE এর উপর। যে বর্ণের আলো শোষণ করে তার সম্পূরক বর্ণের আলো বিকিরিত হয়। ফলে অবস্থান্তর ধাতুর আয়নের দ্রবণটি ঐ নির্দিষ্ট বর্ণের দেখায়। যেমন দৃশ্যমান আলো হতে CuSO4 লাল বর্ণ শোষণ করে এর সম্পূরক নীল বর্ণ ত্যাগ করে।
নোটঃ আশা করি আপনাদের মনে আছে কিভাবে কোনো বস্তুর রং নির্ধারিত হয়। ভুলে গেলে নবম দশম শ্রেনির আলোর প্রতিফলন বিষয়ক অধ্যায়ে দেখুন, অথবা কমেন্টে জানান।
আন্ত অবস্থান্তর মৌল কাকে বলে?
এফ ব্লকের মৌলগুলোকে আন্ত অবস্থান্তর মৌল বলা হয়ে থাকে। ল্যান্থানাইড ও অ্যাক্টিনাইড সিরিজ নিয়ে f-block গঠিত। যদিও f-block মৌল সমূহ গ্রুপ-৩ এর সদস্য, এফ-ব্লক হল মৌলিক পদার্থের পর্যায় সারণির এমন একটি ব্লক যেখানকার মৌলগুলোর ইলেকট্রন বিন্যাসের এফ অক্ষে ইলেকট্রন রয়েছে। এদের মূল ইলেকট্রন বিন্যাস আউফবাউ নীতির ভিত্তির অনুমান থেকে কিছুটা ভিন্ন হতে পারে। অবস্থান্তর মৌলের ন্যায় এরা পরিবর্তনশীল যোজনী প্রদর্শন করে এবং রঙিন যৌগ গঠন করে। অ্যাক্টিনাইড সিরিজের মৌল সমূহের পারমানবিক ভর সংখ্যা ৯২-১০৩ (৮২ অপেক্ষা বেশি) হওয়ায় এরা তেজস্ক্রিয়তা প্রদর্শন করে।ক্রেডিট ও রেফারেন্স
অবস্থান্তর মৌল কাকে বলে?
অবস্থান্তর ধাতু কি?, অবস্থান্তর মৌল সমূহ জটিল যৌগ গঠন করে, অবস্থান্তর ধাতুসমূহ রঙিন যৌগ গঠন করে কেন?, অন্তঃঅবস্থান্তর ধাতু বলতে কি বুঝ? অবস্থান্তর ধাতুর পরিবর্তনশীল জারণ অবস্থা, অবস্থান্তর মৌলের ধর্ম







