কোয়ান্টাম সংখ্যা কাকে বলে? কোয়ান্টাম সংখ্যা সমূহের বর্ণনা

আজকের এই পোষ্টে আমি আপনাদের কোয়ান্টাম সংখ্যা নিয়ে জানাবো। একাদশ-দ্বাদশ ও এইচএসসি শিক্ষার্থীদের জন্য এটি খুবই গুরুত্বপূর্ণ একটি টপিক। কোয়ান্টাম সংখ্যা কি?/কোয়ান্টাম সংখ্যা কাকে বলে? এবং কোয়ান্টাম সংখ্যা সম্পর্কিত বিষয়াবলি নিয়ে সংক্ষিপ্তভাবে মূল বিষয়বস্তু তুলে ধরার চেষ্টা করলাম। আশা করি এই পোষ্ট পড়ে আপনি কোয়ান্টাম সংখ্যা সম্পর্কে বিস্তারিত জানতে পারবেন, MCQ ও সৃজনশীল প্রশ্নের উত্তর করতে পারবেন।
কোয়ান্টাম সংখ্যা কাকে বলে?
পরমাণুতে অবস্থিত কোনো ইলেকট্রনের কক্ষপথ বা শক্তিস্তরের আকার, অরবিটালের আকৃতি, ত্রিমাত্রিক বিন্যাস এবং নিজ অক্ষের চতুর্দিকে আবর্তনের দিক প্রকাশ করতে যেসকল সংখ্যাসমূহ ব্যাবহার করা হয় তাদেরকে কোয়ান্টাম সংখ্যা বলে।অর্থাৎ, পরমাণুর কোয়ান্টাম সংখ্যা হল কোন পরমাণুতে একটি ইলেকট্রন কোন শক্তিস্তরে আছে, উপশক্তিস্তরটি বৃত্তাকার না উপবৃত্তাকার, ইলেকট্রনটি নিজ অক্ষের চারদিকে ক্লকওয়াইজ না অ্যান্টিক্লকওয়াইজ ঘুরছে তা নির্দেশ করার জন্য যে চারটি সংখ্যা ব্যবহার করা হয়।
এই কোয়ান্টাম সংখ্যাগুলো দ্বারা পরমানুতে একটি ইলেকট্রনের অবস্থান সম্পূর্ণরূপে/নির্দিষ্টভাবে প্রকাশ করা যায়। এগুলো হল -
- প্রধান কোয়ান্টাম সংখ্যা (Primary Quantum Number)
- সহকারী কোয়ান্টাম সংখ্যা (Azimuthal Quantum Number)
- ম্যাগনেটিক কোয়ান্টাম সংখ্যা (Magnetic Quantum Number)
- স্পিন কোয়ান্টাম সংখ্যা (Spin Quantum Number)
প্রধান কোয়ান্টাম সংখ্যা
১৯১৩ সালে বিজ্ঞানী নীল'স বোর পরমাণু গঠন সম্পর্কিত যে মতবাদ দেন তা অনুসারে পরমানুর ইলেকট্রনসমূহ কতগুলো নির্দিষ্ট শক্তিস্তরে নিউক্লিয়াসকে কেন্দ্র করে ঘুরছে। এই প্রধান শক্তিস্তরগুলো আবার শেল (Shell) নামেও পরিচিত। এগলোকে যথাক্রমে K,L,M,N,O,P....দ্বারা চিহ্নিত করা হয়। এই শক্তিস্তরগুলোর প্রধান কোয়ান্টাম সংখ্যার মান K=1,L=2,M=3,N=4 এইভাবে উর্ধ্বক্রমে প্রকাশ করা হয়। প্রধান কোয়ান্টাম সংখ্যাকে 'n' দ্বারা চিহ্নিত করা হয়। এবং যে কোনো প্রধান শক্তিস্তরে সর্বোচ্চ 2n² ইলেকট্রন থাকতে পারে (বোরের মতবাদ অনুসারে)। উদাহরণ স্বরূপ, কোন ইলেকট্রেনের প্রধান কোয়ান্টাম সংখ্যা n=2 হলে ইলেকট্রনটি L শেল বা শক্তিস্তরে অবস্থিত। এবং এই শেল বা শক্তিস্তরে সর্বোচ্চ 2n² বা 2×(2)² = 8টি (আটটি) ইলেকট্রন থাকতে পারবে।
সহকারী কোয়ান্টাম সংখ্যা
K,L,M,N.....এই শক্তিস্তরগুলোকে আবার 4টি (চারটি) উপশক্তি স্তরে ভাগ করা হয়েছে, এগুলো হল যথাক্রমে- s,p,d,f| প্রতীক | পূর্ণরূপ/উপশক্তি স্তর | সহকারী কোয়ান্টাম সংখ্যা (ℓ) |
|---|---|---|
| s | Sharp | 0 |
| p | Principle | 1 |
| d | Diffuse | 2 |
| f | Fundamental | 3 |
ইলেকট্রনটি কোন উপশক্তি স্তরে আছে তা নির্দেশ করার জন্য সহকারী কোয়ান্টাম সংখ্যা ব্যবহার করা হয়, যাকে 'ℓ' [ইতালিক l (এল) ] দ্বারা প্রকাশ করা হয়। এই 'ℓ'এর মান 0 হতে n-1 পর্যন্ত হতে পারে। যেমন- n=4 হলে, ℓ=0 হতে 4-1=3 পর্যন্ত বা, 0,1,2,3 এবং উপশক্তি স্তর 4টি, এই ℓ=0,1,2,3, বিভিন্ন উপশক্তিস্তরের নাম নির্দেশ করে। যদি কোন ইলেকট্রনের ক্ষেত্রে ℓ=3 হয় তাহলে উপরের টেবিলে দেওয়া মান অনুসারে ইলেকট্রনটি f=Fundamental উপশক্তিস্তরে আছে। ℓ-এর মান সর্বোচ্চ 3 হতে পার অর্থাৎ কোন প্রধান শক্তিস্তর বা শেলে সর্বোচ্চ 4টি উপশক্তি স্তর থাকতে পারে।

আবার সহকারী কোয়ান্টাম সংখ্যা দ্বারা অরবিটালের আকৃতিও জানা সম্ভব (উপরের ছবিতে দেখুন)। যেমন, যদি ℓ = 0 হয়, তবে ইলেকট্রনটি s উপশক্তি স্তরে আছে, এর আকার গোলক আকৃতির। আবার, যদি ℓ = 1 হয়, তবে ইলেকট্রনটি p উপশক্তি স্তরে আছে, এর আকার ডাম্বেল আকৃতির। তেমনি, যদি ℓ = 2 হয়, তবে ইলেকট্রনটি d উপশক্তি স্তরে আছে, এর আকার জোড়া ডাম্বেল বা ক্লভার পাতা (ক্লভার এক ধরনের ঘাস জাতীয় উদ্ভিদ) আকৃতির।
সহকারী কোয়ান্টাম সংখ্যাকে "কৌণিক ভরবেগ কোয়ান্টাম সংখ্যা" বা ইংরেজিতে "Angular Momentum Quantum Number" বলে,যা মূলত অরবিটালের আকৃতি সম্পর্কে ধারনা প্রদান করে। এছাড়াও সহকারী কোয়ান্টাম সংখ্যা- অরবিটাল কোয়ান্টাম সংখ্যা (Orbital Quantum Number),অ্যাজিমুথ্যাল কোয়ান্টাম সংখ্যা (Azimuthal Quantum Number), সেকেন্ডারি কোয়ান্টাম সংখ্যা (Secondary Quantam Number),সাবসিডিয়ারি কোয়ান্টাম সংখ্যা (Subsidiary Quantum Number) হিসেবেও পরিচিত।
প্রশ্ন : যদি কোন পরমানুর একটি ইলেকট্রনের প্রধান কোয়ান্টাম সংখ্যা '৩' এবং সহকারী কোয়ান্টাম সংখ্যা '১' হয়, তাহলে
- ইলেকট্রনটি কোন শেলে এবং কোন উপশক্তিস্তরে অবস্থিত?
- উপশক্তি স্তরের আকৃতি কেমন?
- যদি ইলেকট্রনটি শেষ কক্ষপথে অবস্থান করে, তবে পরমানুটি পর্যায় সারণির কত তম পর্যায়ের মৌল?
→ (১) M শেল, p উপস্তর, (২) ডাম্বেল আকৃতির, (৩) তৃতীয় পর্যায়।
ম্যাগনেটিক কোয়ান্টাম সংখ্যা
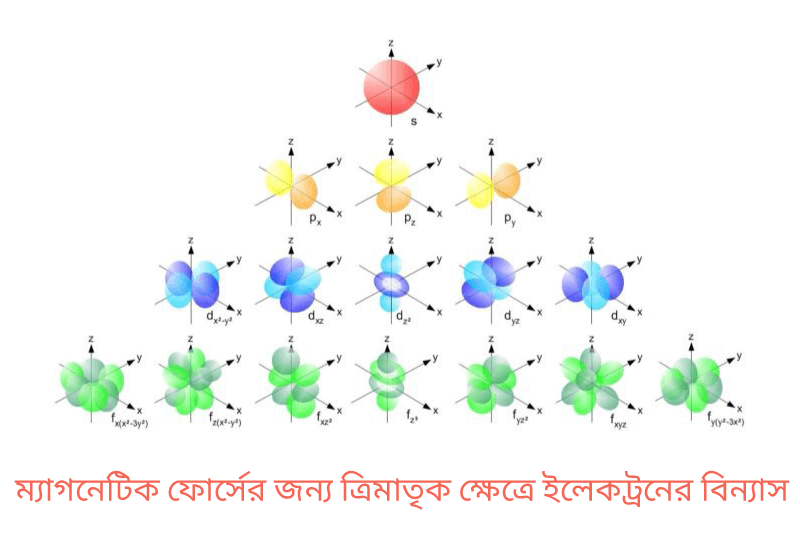
ইলেকট্রন সমূহ নেগেটিভ ও নিউক্লিয়াস পজিটিভ চার্জযুক্ত হওয়ায় পরমাণুর অভ্যন্তরে চৌম্বক ক্ষেত্রের সৃষ্টি হয় এবং ইলেকট্রন কক্ষ পথের ত্রিমাত্রিক দিক বিন্যাস ঘটে। এই বিন্যাসগুলোকে প্রকাশ করার জন্য ম্যাগনেটিক কোয়ান্টাম সংখ্যা 'm' ব্যবহার করা হয়। 'm' এর মান (-)ℓ হতে 0 সহ (+)ℓ পর্যন্ত। যেমন- p অরবিটালে থাকা একটি ইলেকট্রনের ম্যাগনেটিক কোয়ান্টাম সংখ্যা, m=-1,0,1 হবে। 'm' এর মান হতে উপস্তরের কোন অক্ষে ইলেকট্রনটি আছে জানা যায়। মূলত এই -1,0,1 ত্রিমাতৃক স্থানে p এর সম্ভাব্য স্থান নির্দেশ করে। এই ক্ষেত্রে -1,0,1 মান x,y,z অক্ষে অরবিটালের সম্ভাব্য স্থান px,py এবং pz-কে নির্দেশ করছে। এখানে জেনে রাখা ভালো z-অক্ষ বরাবর সবসময়ই m=0 হবে।
স্পিন কোয়ান্টাম সংখ্যা
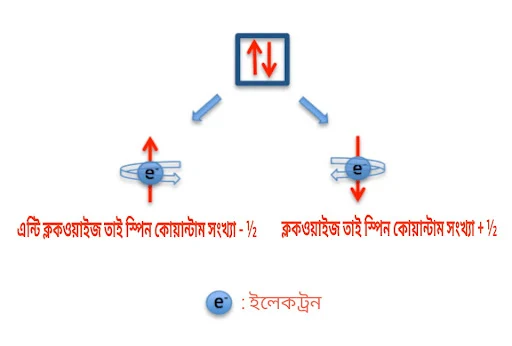
আমরা জানি, প্রতিটি অরবিটালে সর্বোচ্চ দুই এর গুনিতক করে ইলেকট্রন থাকতে পারে, বা ইলেকট্রন সমূহ জোড়ায় থাকে। যেমন d অরবিটালে ৬ টি বা ৩ জোড়া ইলেকট্রন থাকে। যাদের প্রতি জোড়ার প্রথমটির স্পিন ক্লকওয়াইজ (+) হলে অপরটির স্পিন অ্যান্টি ক্লকওয়াইজ (-) হবে। এদের প্রথমটিকে +½ এবং অপরটিকে -½ দ্বারা প্রকাশ করা হয়। তবে সর্বোচ্চ সংখ্যক ইলেকট্রন না থাকলে হুন্ডের নিয়মে অরবিটালে ইলেকট্রন প্রবেশ করবে। হুন্ডের নিয়ম সম্পর্কে বিস্তারিত ইলেকট্রন বিন্যাস নিয়ে পোষ্ট করবো, তাতে পেয়ে যাবেন।
জেনে রাখা ভালো, হুন্ডের নীতি অনুসারে কোনো উপশক্তিস্তরে ইলেকট্রন সমূহ প্রথমে একমূখী ও পরবর্তীতে বিপরীতমূখী হয়ে প্রবেশ করে অরবিটাল পূর্ণ করে।
স্পিন কোয়ান্টাম সংখ্যাকে 's'দ্বারা প্রকাশ করা হয়।
কিন্তু স্পিন সংখ্যা ½ কেন?
স্পিন সংখ্যা বলতে কোন বস্তুর ঘূর্ণন প্রতিসমতা বুঝানো হয়, অর্থাৎ কোন বস্তু ৩৬০ ডিগ্রি ঘূরে আসতে কয় বার পূর্বের অবস্থায় ফিরে আসে। যেমন ইংরেজি বড় হাতের আই 'I' এর ঘূর্ণন প্রতিসমতা ২ কারণ এটি ৩৬০ ডিগ্রি ঘূরে আসতে ২ বার ঘূর্ণনের পূর্বের আকৃতি ধারন করে। কিন্তু ইলেকট্রন সমূহ প্রতি ৭২০ ডিগ্রি পর ঘূর্ণনের পূর্বের আকৃতি ধারন করে, [ আমাদের চারপাশে এই ধরণের বস্তু দেখা যায় না,মূলত ইলেকট্রনসমূহ তীব্র গতিতে ঘূরার ফলে প্রতিনিয়ত রূপ বদল করে এবং ৭২০ ডিগ্রি পরপর পূর্বের অবস্থায় ফিরে আসে ] তাই এদের স্পিন সংখ্যা ½। যেসব মৌলিক কনার ঘূর্ণন সংখ্যা ½ তাদের ফার্মিওন কণা বলে। এছাড়া ±১, ±২, ±৩ ইত্যাদি স্পিন কোয়ান্টাম সংখ্যা বিশিষ্ট মৌলিক কণাসমূহকে বোসন কণা বলে।
কোয়ান্টাম সংখ্যা বিষয়ক সংজ্ঞার্থ
কোয়ান্টাম সংখ্যা বিষয়ক বেশকিছু গুরুত্বপূর্ণ সংজ্ঞার্থ ও টীকা নিচে যুক্ত করে দিলাম।
যে সকল রাশি বা সংখ্যা দ্বারা পরমাণুতে ইলেকট্রনের কক্ষপথ বা শক্তি স্তরের আকার ও আকৃতি, ত্রিমাত্রিক বিন্যাস এবং ইলেকট্রনের কক্ষপথের অক্ষ বরাবর স্পিন বা আবর্তন গতি সম্পর্কে তথ্য পাওয়া যায় তাকে কোয়ান্টাম সংখ্যা বলে।
কোয়ান্টাম সংখ্যা ৪টি। এগুলো হল -
- প্রধান কোয়ান্টাম সংখ্যা
- সহকারী কোয়ান্টাম সংখ্যা
- ম্যাগনেটিক কোয়ান্টাম সংখ্যা ও
- স্পিন কোয়ান্টাম সংখ্যা
যে কোয়ান্টাম সংখ্যার সাহায্যে পরমাণুতে অবস্থিত ইলেকট্রনের শক্তিস্তরের আকার নির্ণয় করা যায় তাকে প্রধান কোয়ান্টাম সংখ্যা বলে। একে n দ্বারা প্রকাশ করা হয়।
সহকারী বা অ্যাজিমুথাল কোয়ান্টাম সংখ্যা এটি পারমাণবিক কক্ষকের জন্য একটি কোয়ান্টাম সংখ্যা যেটি এর কক্ষীয় কৌণিক ভরবেগ নির্ধারণ করে এবং কক্ষপথের আকার বর্ণনা করে। সহকারী কোয়ান্টাম সংখ্যা ইলেকট্রনের অনন্য কোয়ান্টাম অবস্থা বর্ণনা করে অর্থাৎ ইলেকট্রনটি প্রধান শক্তিস্তরের কোন উপশক্তিস্তরে আছে তা নির্দেশ করে।
যে সকল কোয়ান্টাম সংখ্যার সাহায্যে ইলেকট্রনের কক্ষপথের ত্রিমাত্রিক দিক বিন্যাস প্রকরণ সমূহ প্রকাশ করা হয়, তাকে ম্যাগনেটিক কোয়ান্টাম সংখ্যা বা চুম্বকীয় কোয়ান্টাম সংখ্যা বলে। একে m দ্বারা প্রকাশ করা হয়।
নিজস্ব অক্ষের চারদিকে ইলেকট্রনের ঘুর্ণনের দিক প্রকাশক কোয়ান্টাম সংখ্যা সমূহকে স্পিন কোয়ান্টাম সংখ্যা বা ঘূর্ণন কোয়ান্টাম সংখ্যা বলে। এই কোয়ান্টাম সংখ্যা, s দ্বারা একে প্রকাশ করা হয়।







কোয়ান্টাম সংখ্যার প্রকারভেদ এর বর্ননার সময় সেগুলোর প্রবর্তকের কথা বলা হয়নি।
tnq so much for this information...
৭২০° ঘূর্ণনের পর ইলেকট্রন তার পূর্বের আকৃতি ধারন করে এটা বিজ্ঞানীরা কীভাবে বুঝলো? ইলেকট্রন মাইক্রোস্কোপের সাহায্যে নাকি কোনো পরীক্ষার মাধ্যমে?
Thanks
অসংখ্য ধন্যবাদ
অনেক সুন্দর পোষ্টটি। ধন্যবাদ
Thanks